肝癌一线治疗重大突破,T+A免疫联合疗法显著降低肝癌死亡风险42%!
●这是全球首个获得成功的肝癌免疫疗法临床III期研究,结果显示,针对不可切除的肝细胞癌患者,与索拉非尼相比,阿替利珠单抗与贝伐珠单抗免疫联合疗法能够改善患者的总生存期(OS)与无进展生存期(PFS)
●研究结果于2019年欧洲肿瘤内科学会(ESMO)亚洲大会的主席会议上对外公布
巴塞尔,2019年11月22日 - 罗氏集团(SIX:RO,ROG;OTCQX:RHHBY)今日正式公布旨在评估Tecentriq(阿替利珠单抗[atezolizumab])与安维汀(贝伐珠单抗)联合疗法用于肝癌治疗的IMbrave 150 III期临床试验的阳性研究数据。数据显示,针对既往未接受过系统性治疗的不可切除的肝细胞癌(HCC)患者,与现有索拉非尼标准治疗组相比,Tecentriq与安维汀免疫联合治疗组患者的总生存期(OS)与无进展生存期(PFS)均获得显著统计学及具有临床意义的改善。
研究结果显示,与索拉非尼相比,Tecentriq与安维汀免疫联合疗法可以使患者死亡风险(OS)降低42%(风险比[HR] = 0.58;95% CI:0.42-0.79; p = 0.0006),同时使得疾病恶化或死亡风险(PFS)降低41%(HR = 0.59;95% CI:0.47–0.76; p <0.0001)。此外,Tecentriq与安维汀免疫联合疗法的安全性特征与此前单独用药的已知安全性特征一致。
罗氏首席医学官兼全球产品开发负责人Levi Garraway博士说:“十年来,我们首次看到一种联合疗法能够优于当前的标准疗法,帮助不可切除的肝细胞癌患者延长总生存期。针对这类侵袭性很强的疾病,Tecentriq与安维汀免疫联合疗法将带来治疗领域的变革。我们正在与全球医疗监管部门密切合作,希望尽快将这种治疗方案带给患者。”
肝细胞癌是最常见的肝癌类型,全球每年有超过75万人罹患肝细胞癌,大多数病例来自亚洲,其中几乎一半来自中国。欧洲和美国的肝癌发病率也都在上升。自1980年以来,美国肝癌病例数增加了两倍多。
这些研究数据于11月23日上午11:00(新加坡标准时间)举行的2019年欧洲肿瘤内科学会(ESMO)亚洲大会的主席会议上对外公布(摘要:LBA3)。
罗氏为阿替利珠单抗制定了广泛的临床开发计划,其中包括多项正在进行和计划进行的III期研究,涵盖肺癌、生殖泌尿系统肿瘤、皮肤癌、乳腺癌、胃肠肿瘤、妇科癌症和头颈癌,包括旨在评估阿替利珠单抗单药治疗和与其他药物进行免疫联合治疗的研究。
关于IMbrave150研究
IMbrave150是一项在501名既往未接受过系统性治疗的不可切除的肝细胞癌患者中开展的全球性III期、多中心、开放性研究。患者按照2:1的比例随机接受阿替利珠单抗和贝伐珠单抗联合治疗或索拉非尼治疗。在每21天周期的第1天经静脉注射给予阿替利珠单抗1200 mg;在每个21天周期的第1天经静脉注射给予贝伐珠单抗15 mg/kg。在每21天周期的第1-21天口服给予索拉非尼,400 mg,每天2次。患者接受联合治疗或对照组治疗,直至出现不可耐受的毒性或研究者确定无临床获益。该研究的共同主要终点为OS和独立审查机构(IRF)根据RECIST v1.1评估的PFS。其他研究终点包括根据RECIST v1.1(研究者评估的[INV]和IRF)和HCC mRECIST(IRF)评估的总缓解率(ORR)、至疾病进展的时间(TTP)和缓解持续时间(DOR)以及患者报告结局(包括患者报告的至生活质量发生恶化的时间)、安全性和药代动力学。
主要疗效终点OS和PFS的结果(共同主要研究终点)如下:
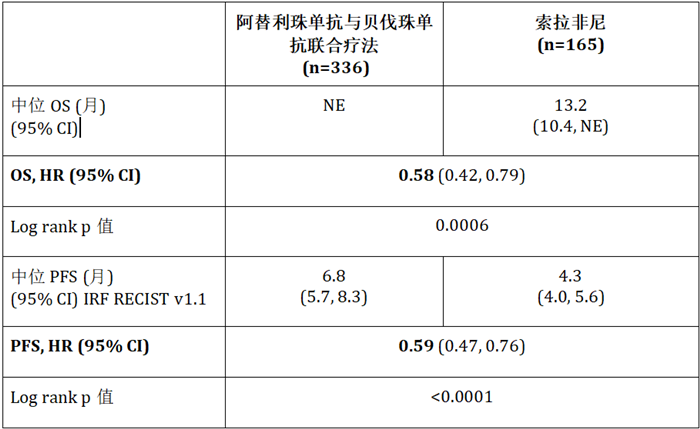
NE:无法评估(阿替利珠单抗和贝伐珠单抗联合治疗组的中位总生存期尚未达到。对照组CI上限无法评估); 中位随访:8.6个月; PFS基于IRF RECIST v1.1评估。
在接受阿替利珠单抗与贝伐珠单抗联合疗法的患者中,57%发生了3-4级不良事件。在接受索拉非尼治疗的患者中,有55%发生了3-4级不良事件。在两个治疗组中,发生5级不良事件的患者比例分别为5%和6%。
关于肝细胞癌
肝细胞癌(HCC)是一种治疗选择有限的侵袭性癌症,是全球癌症死亡的主要原因之一。 每年有750,000人罹患肝细胞癌,大多数病例来自亚洲,其中几乎一半来自中国。在美国,自1980年以来,肝癌病例的数量翻了三倍,而肝细胞癌更是所有癌症相关的致死原因当中上升最快的一个,在欧洲,肝癌的发病率同样在上升。肝细胞癌主要发生于慢性肝炎(乙型或丙型)或酗酒引起的肝硬化患者中,并且通常在确诊时已是晚期。 不可切除肝细胞癌的预后仍然很差,系统性治疗选择很少,确诊后1年生存率不足50%。
关于阿替利珠单抗和贝伐珠单抗联合治疗
阿替利珠单抗和贝伐珠单抗免疫联合疗法已获得强有力的医学证据支持。阿替利珠单抗和贝伐珠单抗联合治疗可增强免疫系统对抗多种癌症的潜力。除具有已知的抗血管生成作用外,贝伐珠单抗还可通过抑制血管内皮生长因子(VEGF)相关免疫抑制作用、促进T细胞肿瘤浸润以及启动和激活T细胞对肿瘤抗原的应答,以进一步增强阿替利珠单抗激活免疫系统杀灭肿瘤细胞的能力。
关于阿替利珠单抗
阿替利珠单抗是一种设计用于直接与肿瘤细胞和肿瘤浸润免疫细胞上表达的PD-L1配体蛋白结合的单克隆抗体,可阻断其与PD-1和B7.1受体的相互作用。通过阻断PD-L1通路,阿替利珠单抗可以有效激活T细胞。阿替利珠单抗是一种免疫检查点抑制剂,有望作为免疫联合疗法的基础用药,与其他免疫抑制剂、靶向药物和各种化疗药联合用于治疗多种癌症。基于对免疫系统如何与肿瘤相互作用以及如何利用患者自身的免疫系统更有效地对抗癌症的深入理解,我们开发了阿替利珠单抗以及开展多项临床研究。
目前,阿替利珠单抗已在美国、欧盟和世界各国获得批准,作为单药治疗或联合靶向疗法和/或化疗用于治疗非小细胞肺癌和小细胞肺癌、特定类型转移性尿路上皮癌和PD-L1高表达的转移性三阴性乳腺癌等多种类型的癌症。
关于贝伐珠单抗
贝伐珠单抗是一种通过静脉输注的处方类生物制剂,能够与VEGF蛋白特异性结合,而VEGF在肿瘤整个生命周期中的血管新生和血管维护方面发挥重要作用,这一过程称为血管生成。贝伐珠单抗可以通过直接结合VEGF蛋白,来阻止它与血管内皮细胞上的受体相互作用,从而阻止肿瘤的血液供应。肿瘤血液供应被认为是肿瘤在体内生长和扩散(转移)能力的关键。
关于罗氏的癌症免疫疗法研究
50多年来,罗氏一直致力于开发创新药物,重新定义癌症的治疗。今天,我们投入比以往更多的资源,致力于研发创新的治疗方案,帮助激活患者自身免疫系统抗击癌症。
通过设计肿瘤免疫周期框架,并在框架下开展肿瘤免疫分析领域的开拓性研究,罗氏正在加速推进并扩大阿替利珠单抗所带来的临床获益,以改变现有免疫治疗格局,同时让更广大的癌症患者获益。我们的癌症免疫疗法研究采用了综合方案来实现重建免疫力抗击肿瘤的目标,以改善患者预后。
.63亿建设全新的罗氏创新中心上海,预计将于2019年竣工。建成后的创新中心将聚焦于研究与早期开发免疫、炎症及抗感染疾病领域的创新型药品。未来,它将有效促进罗氏与本土科研机构的合作,持续不断地为中国和全球患者开发优异创新的药品。此外,创新中心配备了世界一流的研究设施,吸引海内外顶尖创新医药人才不断涌入。秉承“先患者之需而行”的承诺,上海将成为罗氏继旧金山和巴塞尔之后的第三大全球战略中心。
随着改革开放的不断深化,中国政府推出了一系列医疗改革的新举措,尤其是在加速新药注册审批流程、更新国家医保目录等方面。目前,罗氏共有五款靶向药物——赫赛汀、安维汀、美罗华、特罗凯、佐博伏被列入国家医保目录,惠及中国患者。此举,不但极大降低了癌症患者的经济负担,也促进了中国肿瘤治疗领域的规范化发展。
2018年4月,李克强总理在上海考察时特意造访罗氏制药中国。此行彰显了总理对生物制药行业的高度重视,也展现了罗氏制药中国作为跨国药企,扎根中国,长足发展的成果与决心。
“引领创新,为中国患者创造具有差异化的价值”,是罗氏制药中国的五年战略。我们将积极与政府、医疗机构以及非政府组织等社会各界多方携手,共同探索创新的合作模式,通过一系列有影响力和可持续的举措惠及更多的中国患者。
家庭医生在线(www.familydoctor.com.cn)原创内容,未经授权不得转载,违者必究,内容合作请联系:020-37617238




